JUAN RIERA ROCA / El Departamento de Defensa de los Estados Unidos financia una nueva aproximación terapéutica contra el cáncer de próstata más agresivo. Se trata de un proyecto conjunto entre la Universidad de Washington, el CNIO y el VHIO coincidiendo con ‘Movember’, el mes de la concienciación de la salud masculina que se celebra en noviembre.
EEUU ha otorgado un ‘Impact Award’ para explorar nuevas opciones terapéuticas contra el cáncer de próstata avanzado ―resistente a la castración o bloqueo hormonal―a un consorcio de investigadores integrado por la Unidad de Investigación Clínica de Cáncer de Próstata del Centro Nacional de Investigaciones Oncológicas (CNIO), que dirige David Olmos.
También participan el Grupo de Investigación Traslacional en Cáncer de Próstata del Vall d’Hebron Instituto de Oncología (VHIO), que dirige Joaquin Mateo, y el Laboratorio de Genética de Tumores Sólidos de la Universidad de Washington, liderado por Colin Pritchard. El consorcio recibirá 2 millones de dólares para este proyecto de 3 años de duración.
Durante ese periodo se estudiará cómo identificar nuevos marcadores predictores a la respuesta a tratamientos, para identificar qué pacientes responden peor a las terapias y así ofrecerles otras opciones terapéuticas. El cáncer de próstata es el más frecuente en hombres en España y en los países occidentales, y el segundo a nivel mundial.
Supone la tercera tasa de muerte en hombres europeos, aunque en los últimos años la supervivencia está aumentando de forma continuada, probablemente debido al diagnóstico precoz. La forma más habitual de combatirlo en su fase avanzada es a través del tratamiento de bloqueo hormonal, pero algunos pacientes desarrollan tumores agresivos resistentes a este tratamiento.
Hasta un 90% de los que se hacen resistentes desarrollan metástasis, habitualmente en hueso y ganglios, aunque también puede extenderse a hígado y pulmón. La supervivencia media en los pacientes con enfermedad avanzada suele ser de aproximadamente 2 años tras el diagnóstico. Además, hasta un tercio de ellos responde peor a las terapias aprobadas para cáncer de próstata.
Hasta la fecha se desconoce la mejor forma de identificarlos y predecir su respuesta a los tratamientos. El proyecto tratará de identificar a este conjunto de pacientes con el desarrollo de nuevos marcadores predictores de la respuesta a tratamientos y, mediante un ensayo clínico, comprobar si una terapia que funciona para otros tipos tumorales como mama y ovario.
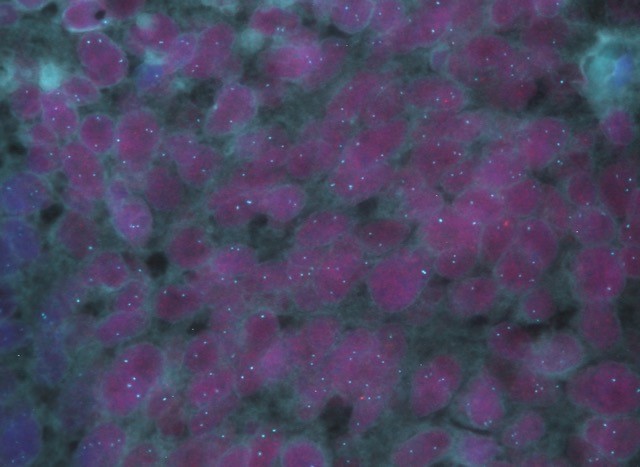
Ello podría revelarse eficaz también para los pacientes con cáncer de próstata avanzado que presenten estos marcadores. Los investigadores estudiarán patrones genéticos y moleculares que se asocien a los defectos en los mecanismos de reparación del ADN, es decir, si las células de sus tumores reparan correctamente o no los errores que se producen en su material genético.
«Nuestra línea de trabajo siempre se ha enfocado en estos mecanismos», explica Elena Castro, de la Unidad de Investigación Clínica de Cáncer de Próstata del CNIO, y añaden: «Es una aproximación que está dando buenos resultados en la investigación del cáncer de próstata». Los investigadores esperan que estos tumores respondan a terapias con carboplatino.
Se trata de un fármaco eficaz en tipos tumorales que muestran esta clase de defectos, como el de mama y ovario. «Estas terapias impiden que las células reparen los defectos de su ADN. Debido a que las células tumorales tienen muchos más defectos genéticos que las células normales, estos fármacos son muy efectivos para provocar su colapso y muerte», expone David Olmos, jefe de esta Unidad.
En la primera parte de este proyecto, se estudiarán las muestras de tumores recogidas a los pacientes que participaron en PROREPAIR-B, el primer estudio prospectivo realizado hasta la fecha a nivel mundial en pacientes con cáncer de próstata avanzado que portan mutaciones heredables, coordinado desde el CNIO que ha hecho un seguimiento de más de 400 pacientes desde 2013.
La idea ha sido analizar si sus genes de reparación del daño del ADN tienen alteraciones genéticas heredadas y cómo afectan estas a la respuesta a los tratamientos. Ahora, se secuenciarán estas muestras para verificar cómo se comportan las alteraciones de estos genes que no son heredadas y ocurren solo en el tumor.
A continuación, el equipo de VHIO liderado por Joaquin Mateo buscará biomarcadores para los defectos de reparación del ADN en estos pacientes, ya que estos defectos no siempre están originados por una mutación genética heredada. «Hemos demostrado que muchos pacientes con cáncer de próstata avanzado desarrollan defectos de reparación del ADN en sus tumores, aunque no haya una mutación heredada», explica Joaquín Mateo, del VHIO y oncólogo del Hospital Vall d’Hebron.
«Además, sabemos que algunos tumores tienen comportamientos similares a los que tienen estas mutaciones, aunque no las identifiquemos. Así pues, queremos investigar patrones biológicos que se asocien con patrones clínicos, y para ello estudiaremos estos tumores integrando diferentes herramientas en el laboratorio», añade Mateo.
El objetivo es contar con nuevas señales indicadoras de estos fallos (más allá de las mutaciones genéticas) que permitan acelerar a toma de decisiones sobre los tratamientos a aplicar. Por último, el equipo del CNIO con apoyo de VHIO y otros centros españoles llevarán a cabo un ensayo clínico para confirmar si las terapias con carboplatino podrían ser eficaces en cáncer de próstata avanzado.
«Sabemos que el carboplatino funciona muy bien en tumores con defectos de reparación del ADN por pacientes de mama y ovario, y en próstata se presupone, pero no se sabe con seguridad», dice Olmos. «Pero en lugar de seleccionar a los pacientes en base a si tienen mutaciones genéticas que podrían provocar defectos de reparación, como se suele hacer, los seleccionaremos utilizando los biomarcadores.
»Biomarcadores que habremos detectado previamente, ya que creemos que será más fiable a la hora de determinar la eficacia del tratamiento. Es decir, seleccionaremos a los pacientes en función de si su tumor repara su ADN o no, independientemente de cómo sea su perfil genético».
Otra ventaja radica en que se trata de una terapia económica y de fácil acceso. Un fármaco que ya se sabe que tiene eficacia en los tumores con defectos de la reparación del ADN son los llamados inhibidores de PARP, pero su coste es elevado. «Si el carboplatino se revela como una buena opción terapéutica, los resultados de nuestro ensayo impactarían muy positivamente en los pacientes», concluye Olmos.
A lo que añade Mateo: «Al tratarse de un fármaco ya aprobado y utilizado rutinariamente para otros tipos tumorales, como cáncer de mama y ovario, el camino del carboplatino hasta la clínica para beneficiar a los pacientes de cáncer de próstata sería mucho más corto de lo habitual. Existe poca experiencia con el uso de este fármaco en el cáncer de próstata, pero hasta la fecha es prometedora. Con este estudio buscamos poder confirmarlo».
El Departamento de Defensa de EE.UU. creó los Programas de Investigación Médica Dirigidos por el Congreso (CDMRP) en 1992, y sus convocatorias se han convertido en las más importantes del país en investigación biomédica, junto con las de los Institutos Nacionales de Salud (NIH). En 1997, lanzó el Programa de Investigación del Cáncer de Próstata para financiar investigación de alto impacto y con relevancia clínica en el corto plazo para este tipo tumoral.