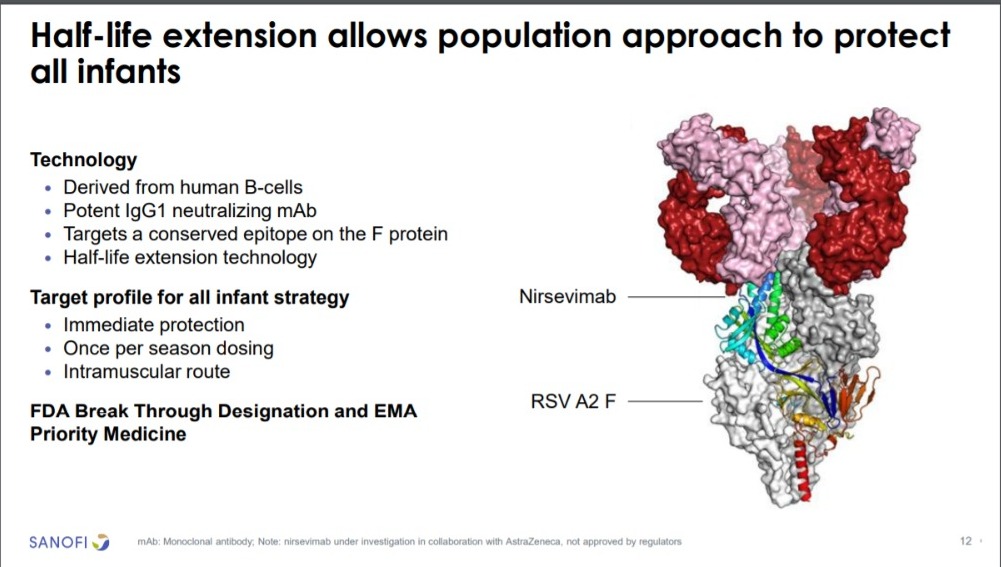
La Agencia Europea de Medicamentos (EMA) ha concedido la evaluación acelerada a la solicitud regulatoria de nirsevimab, desarrollado para proteger a los lactantes frente al virus respiratorio sincitial (VRS). Nirsevimab es el primer anticuerpo monoclonal de vida media extendida en investigación desarrollado para proteger a todos los lactantes durante la temporada de virus respiratorio sincitial (VRS) con una única dosis
La decisión regulatoria europea podría ser tomada en el segundo semestre de 2022. Si se aprueba, nirsevimab será la primera inmunización de su tipo en proporcionar protección frente al VRS en todos los lactantes. Así pues, la EMA ha aceptado la solicitud de autorización de comercialización para nirsevimab bajo un procedimiento de evaluación acelerada.
Sanofi y AstraZeneca están desarrollando nirsevimab, el primer anticuerpo monoclonal de vida media extendida desarrollado para proteger a todos los lactantes frente a las infecciones de las vías respiratorias inferiores (IVRI) que precisan atención médica durante la temporada del virus respiratorio sincitial (VRS). Nirsevimab está siendo desarrollado como una dosis única para todos los lactantes que experimentan su primera temporada de VRS.
La EMA concedió la evaluación acelerada para nirsevimab debido a que el Comité de Medicamentos de Uso Humano (Committee for Medicinal Products for Human Use, CHMP) considera que es de gran interés para la salud pública y significa una importante innovación terapéutica. El objetivo de la evaluación acelerada es reducir el marco temporal en el que el CHMP revisa una solicitud de autorización de comercialización.
“El VRS es una de las principales causas de hospitalización en todos los lactantes. Los recientes picos de casos de bronquiolitis y hospitalizaciones causadas por la infección por VRS, en todo el mundo, demuestran aún más la necesidad de una opción preventiva que ayude a proteger a todos los lactantes», ha explicado Jean-François Toussaint, Director Global de Investigación y Desarrollo de Sanofi Vacunas.
«Estamos encantados de que se haya aceptado esta solicitud de regulación, y confiamos en el potencial de nirsevimab para cambiar el actual paradigma de prevención del VRS como una posible opción de dosis única que puede ofrecer protección sostenida a todos los bebés durante la temporada”, ha añadido. La solicitud se basa en los resultados positivos del ensayo MELODY, el ensayo MEDLEY y el ensayo en fase 2b.
Estos ensayos demostraron la eficacia de nirsevimab frente a IVRI por VRS mediante la administración de una única dosis protegiendo toda la temporada de VRS y con un perfil de seguridad favorable. Los datos del ensayo MELODY y MEDLEY se publicarán próximamente en una revista científica revisada por pares.
Mene Pangalos, vicepresidente ejecutivo de Investigación y Desarrollo de productos biofarmacéuticos de AstraZeneca, ha recordado que «cada año, el VRS causa epidemias estacionales de infecciones de las vías respiratorias inferiores en lactantes, y las opciones preventivas actualmente se limitan a los lactantes de alto riesgo.
»Nos anima que la EMA haya aceptado esta solicitud de regulación bajo el procedimiento de evaluación acelerada, ya que nirsevimab tiene el potencial de ser la primera inmunización que ofrezca protección a todos los lactantes frente al virus respiratorio sincitial como demuestra su amplio programa de ensayos clínicos», ha añadido el responsable de AstraZeneca. Se han previsto otras solicitudes regulatorias a nivel internacional en 2022.
El VRS es un virus común contagioso, que causa epidemias estacionales de infecciones de las vías respiratorias inferiores (IVRI) y es la causa principal de bronquiolitis y neumonía en lactantes. También es una de las causas principales de hospitalización en todos los lactantes. En 2015, hubo aproximadamente 30 millones de casos de infecciones agudas de las vías respiratorias inferiores en todo el mundo.
Estas infecciones provocaron más de tres millones de hospitalizaciones y 60.000 muertes hospitalarias de niños menores de 5 años. En los meses recientes, se ha producido un repunte del VRS como consecuencia de la relajación de las medidas de salud pública implantadas por motivo del COVID-19. La mayoría de hospitalizaciones por VRS se producen en lactantes previamente sanos y nacidos a término.
Las IVRI que precisan atención médica generan un incremento de los costes para el sistema sanitario. Nirsevimab es el primer anticuerpo monoclonal de vida media extendida en investigación desarrollado para proteger a todos los lactantes durante la temporada de virus respiratorio sincitial (VRS) con una única dosis.
Debido a su tecnología de semivida ampliada, nirsevimab se está desarrollando a través de la administración de una dosis única para todos los lactantes que experimentan su primera temporada de VRS y los lactantes con condiciones específicas como cardiopatía congénita o enfermedad pulmonar crónica en su primera y segunda temporada de VRS.
Nirsevimab es una inmunización desarrollada para ofrecer protección profiláctica directa frente al VRS a todos los lactantes a través de un anticuerpo administrado para ayudar a prevenir las IVRI causadas por el VRS. Los anticuerpos monoclonales no requieren la activación del sistema inmunitario para ofrecer una protección rápida y directa frente la enfermedad.16
En marzo de 2017, Sanofi y AstraZeneca anunciaron un acuerdo para desarrollar y comercializar nirsevimab. En virtud de los términos del acuerdo, AstraZeneca dirige todas las actividades de desarrollo y fabricación, y Sanofi dirigirá las actividades de comercialización y registro de ingresos. De acuerdo con los términos del acuerdo internacional, Sanofi realizó un pago inicial de 120 millones de euros.
Además de un objetivo de desarrollo alcanzado de 30 millones de euros, Sanofi pagará hasta 465 millones de euros adicionales al alcanzar determinados objetivos de desarrollo y de ventas. Ambas empresas comparten todos los costes y beneficios. Los ingresos generados por el acuerdo se registran como ingresos de colaboración en los estados financieros de la empresa.
Nirsevimab ha recibido designaciones regulatorias para facilitar el desarrollo acelerado por parte de cinco importantes agencias reguladoras de todo el mundo. Estas incluyen la designación de Terapia Innovadora por parte del Centro de China para la evaluación de fármacos bajo la Administración Nacional de Productos Médicos (NPMA); la designación de Terapia Innovadora de la Administración de Alimentos y Medicamentos de EE. UU. (FDA).
También, el acceso concedido al plan de PRIority Medicines (PRIME) de la EMA), la designación de Medicina Promisoria Innovadora por parte de la Agencia Reguladora de Medicamentos y Productos Sanitarios del Reino Unido (MHRA) y ha sido nombrado «un medicamento para el desarrollo prioritario» en el Proyecto de Selección de Fármacos para la Promoción del Desarrollo de Nuevos Fármacos en Pediatría por la Agencia Japonesa.
Nirsevimab está actualmente en investigación clínica, y ninguna autoridad reguladora ha revisado su seguridad y eficacia. Toda la información de esta noticia procede de un comunicado de prensa emitido por la compañía farmacéutica Sanofi España.