Las compañías farmacéuticas Sanofi y GSK han anunciado hoy que tienen la intención de presentar los datos de sus ensayos de dosis de refuerzo y de eficacia de fase 3 como base para las solicitudes reglamentarias de una nueva vacuna contra el COVID19. La vacuna Sanofi-GSK se basa en proteínas adyuvada, estable a temperatura de refrigeración.
Esta vacuna está fuertemente respaldada por la inducción de respuestas inmunitarias sólidas y un perfil de seguridad favorable en múltiples entornos. En los participantes que habían recibido una vacuna de ARNm o adenovirus ya autorizada, la vacuna de refuerzo de Sanofi-GSK indujo un aumento significativo de anticuerpos neutralizantes.
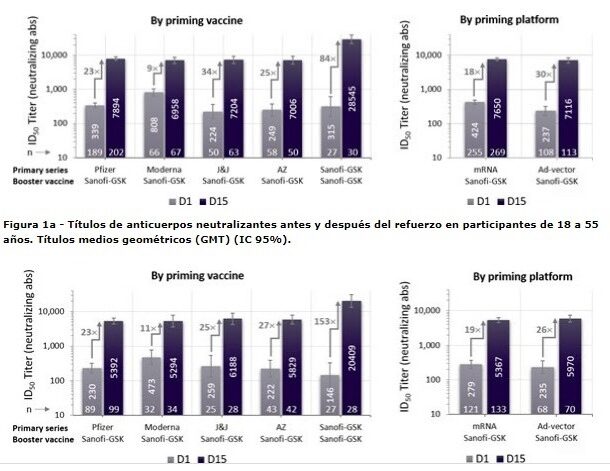
Este aumento se estimó de 18 a 30 veces en todas las plataformas de vacunas y grupos de edad. Cuando la vacuna Sanofi-GSK se utilizó como una serie primaria de dos dosis seguidas de una dosis de refuerzo, los anticuerpos neutralizantes aumentaron entre 84 y 153 veces en comparación con los niveles previos al refuerzo (véanse las figuras 1a y 1b para más detalles).
Thomas Triomphe, vicepresidente Ejecutivo de Sanofi Vacunas, ha dicho que «estamos muy satisfechos con estos datos, que confirman nuestra sólida ciencia y los beneficios de nuestra vacuna COVID-19. La vacuna Sanofi-GSK demuestra una capacidad universal como refuerzo para todas las plataformas y en todas las edades».
Y que «también hemos observado una sólida eficacia de la vacuna como serie primaria en el difícil entorno epidemiológico actual. No se ha realizado ningún otro estudio global de eficacia de fase 3 durante este periodo con tantas variantes de interés, incluyendo Omicron, y estos datos de eficacia son similares a los datos clínicos recientes de las vacunas autorizadas.»
Roger Connor, presidente de GSK Vacunas, ha dicho que «la evolución de la epidemiología de COVID-19 demuestra la necesidad de una variedad de vacunas. Nuestra vacuna adyuvada basada en proteínas utiliza un enfoque bien establecido que se ha aplicado ampliamente para prevenir la infección con otros virus, incluida la gripe pandémica».
Y ha añadido que «confiamos en que esta vacuna pueda desempeñar un papel importante a medida que sigamos haciendo frente a esta pandemia y nos preparemos para el periodo pospandémico.» Cuando se utilizó como una serie primaria de dos dosis, la vacuna Sanofi-GSK proporcionó sólidos niveles de anticuerpos neutralizantes.
Se detectaron GMTs (títulos medios geométricos) que alcanzaron las 3711 unidades. A modo de comparación, un panel de sueros de voluntarios del mismo rango de edad que recibieron dos dosis de una vacuna de ARNm ya aprobada y altamente eficaz mostró un GMT de 1653 unidades, medido simultáneamente en el mismo laboratorio.
Los datos del estudio de eficacia VAT08 mostraron que dos dosis de la vacuna Sanofi-GSK generaron una eficacia del 57,9% (intervalo de confianza del 95% [IC, 26,5, 76,7]) contra cualquier enfermedad sintomática de COVID19 en la población seronegativa. La vacuna Sanofi-GSK proporcionó una protección del 100%.
Ese resultado se reflejó en 0 frente a 10 casos después de la dosis 1, 0 frente a 4 casos después de la dosis 2) contra la enfermedad grave y las hospitalizaciones y una eficacia del 75% (3 frente a 11 casos) contra la enfermedad de moderada a grave en poblaciones seronegativas.
Aunque la secuenciación aún está en curso, los primeros datos indican una eficacia del 77% contra la enfermedad sintomática de COVID-19 asociada a la variante Delta, en línea con la eficacia esperada de la vacuna. En ambos estudios, la vacuna Sanofi-GSK fue bien tolerada en adultos jóvenes y personas mayores sin problemas de seguridad.
Las empresas están en conversaciones con las autoridades reguladoras, incluidas la FDA estadounidense y la Agencia Europea del Medicamento (EMA), y tienen previsto presentar la totalidad de los datos generados con esta vacuna candidata para respaldar las autorizaciones reglamentarias.
Para evaluar la inmunogenicidad de la vacuna Sanofi-GSK como refuerzo, Monogram Biosciences [San Francisco, CA] analizó muestras de suero humano inmune utilizando una prueba de neutralización de pseudovirus (pVNT) estandarizada y aprobada por la FDA contra el virus prototipo D614G.
El ensayo de fase 3, VAT08, evalúa la eficacia, la inmunogenicidad y la seguridad de una formulación de antígeno de 10 µg de la vacuna basada en una proteína recombinante adyuvada contra el SARS-CoV-2 en comparación con un placebo. En la primera fase del ensayo, se está evaluando la eficacia de una formulación de la vacuna que contiene la proteína de la espiga.
Esta proteína es contra el virus original D614 (matriz) y se ha probado en más de 10.000 participantes de 18 años, asignados al azar para recibir dos dosis de 10µg de vacuna o placebo en el día 1 y en el día 22 en centros de Estados Unidos, Asia, África y América Latina.
Recientemente se ha completado el reclutamiento para una segunda fase del ensayo, que evalúa una segunda formulación bivalente, que incluye la proteína de espiga de la variante B.1.351 (Beta). El ensayo de fase 3 sigue a los resultados iniciales positivos de un ensayo clínico de fase 2 (VAT00002).
En ese ensayo, la vacuna candidata COVID-19 se administró a 722 adultos para evaluar la seguridad, la reactogenicidad y la inmunogenicidad de 2 dosis y para identificar una dosis óptima para su uso como refuerzo. Los resultados mostraron fuertes tasas de respuesta de anticuerpos neutralizantes entre el 95% y el 100% de seroconversión tras una segunda inyección en todos los grupos de edad (de 18 a 95 años), en todas las dosis. Los resultados completos de los estudios VAT08 y VAT02 se publicarán a finales de este año.
Estos esfuerzos cuentan con el apoyo de fondos federales de la Autoridad de Investigación y Desarrollo Biomédico Avanzado, que forma parte de la oficina del Subsecretario de Preparación y Respuesta del Departamento de Salud y Servicios Humanos de los Estados Unidos, en colaboración con la Oficina Ejecutiva del Programa Conjunto de Defensa Química, Biológica, Radiológica y Nuclear del Departamento de Defensa de los Estados Unidos, en virtud del contrato nºW15QKN-16-9-1002, y del Instituto Nacional de Alergias y Enfermedades Infecciosas (NIAID). El NIAID financia el Centro de Liderazgo y Operaciones de la Red de Ensayos de Vacunas contra el VIH (HVTN) (UM1 AI 68614HVTN), el Centro de Estadística y Gestión de Datos (UM1 AI 68635), el Centro de Laboratorio de la HVTN (UM1 AI 68618), el Centro de Liderazgo y Operaciones de la Red de Ensayos de Prevención del VIH (UM1 AI 68619), el Centro de Liderazgo y Operaciones del Grupo de Ensayos Clínicos del SIDA (UM1 AI 68636) y el Consorcio de Investigación Clínica de Enfermedades Infecciosas (UM1 AI 148684, UM1 AI 1488450, UM1 AI 148372 , UM1 AI 148574).