Los nuevos datos del ensayo clínico fase 3b HARMONIE, muestran una reducción del 83,21 % en las hospitalizaciones causadas por enfermedad del tracto respiratorio inferior (ETRI) relacionadas con el virus sincital respiratorio (RSV, siglas en inglés), en menores de 12 meses que recibieron una dosis única de nirsevimab, en comparación con los en los que no se realizó ninguna intervención.
El estudio Hospitalized RSV Monoclonal Antibody Prevention (HARMONIE) es un amplio ensayo clínico de intervención europeo y multinacional, cuyo objetivo es determinar la eficacia y la seguridad de una dosis única intramuscular de nirsevimab, con datos obtenidos en un entorno de vida real durante la temporada de VRS 2022-2023.
El ensayo reclutó a más de 8.000 lactantes y se llevó a cabo en casi 250 centros de Francia, Alemania y Reino Unido. Los datos de HARMONIE se han presentado en la 41ª Reunión Anual de la Sociedad Europea de Enfermedades Infecciosas Pediátricas (ESPID).
Thomas Triomphe, vicepresidente ejecutivo, Vacunas, Sanofi, ha dicho al respecto:
“Este invierno se observaron mayores tasas de hospitalizaciones infantiles relacionadas con el VRS que durante los años de pandemia o prepandemia. Los datos de HARMONIE demuestran el impacto de nirsevimab sobre las hospitalizaciones pediátricas en vida real, y ponen de manifiesto su importancia para los lactantes, sus familias y la salud pública”.
El Prof. Federico Martinón, Pediatra e investigador clínico del Hospital Clínico Universitario de Santiago, ha añadido:
«Los datos del estudio HARMONIE, ratifican la seguridad y eficacia que permitieron la aprobación de esta profilaxis por parte de la Agencia Europea del Medicamento. Contar con un estudio tan amplio, en el que se administra la inmunoprofilaxis en condiciones similares a las que se usaría en la práctica real, y ver una efectividad tan elevada y que se puede reducir más del 80% de las hospitalizaciones causadas por el VRS en lactantes sanos, constituye una noticia excelente a todos los niveles”.
Los datos de HARMONIE también muestran que nirsevimab redujo en un 75,71 % la incidencia de hospitalizaciones debidas a enfermedad grave en el tracto respiratorio inferior (pacientes cuyo nivel de oxígeno es inferior al 90 % y requieren un aporte suplementario) relacionadas con el VRS.
Además, demostró una reducción del 58,04 % en la incidencia de la hospitalización por ETRI por cualquier causa en comparación con los lactantes en los que no se realizó ninguna intervención frente al VRS.1 Esto significa que la carga general en los sistemas sanitarios podría reducirse significativamente si todos los lactantes reciben nirsevimab.
Los costes médicos directos relacionados con el VRS, en todo el mundo —incluidos los cuidados hospitalarios, ambulatorios y de seguimiento— se estimaron en 4.820 millones de euros en 2017. Durante el estudio HARMONIE, nirsevimab mantuvo un perfil de seguridad favorable, consistente con los resultados del ensayo pivotal.
El VRS es la causa más frecuente de enfermedades respiratorias infantiles como la bronquiolitis y la neumonía en lactantes. También es una causa principal de hospitalización en todos los lactantes. La mayoría de las hospitalizaciones por VRS se producen en lactantes que estaban sanos y que habían nacido a término.
A nivel mundial, en 2019, hubo aproximadamente 33 millones de casos de infecciones agudas de las vías respiratorias inferiores que provocaron más de tres millones de hospitalizaciones y 26.300 muertes hospitalarias de niños menores de cinco años. En España es responsable del 80% de las bronquiolitis y de la mayoría de las neumonías en menores de un año.
La mayoría de los niños (90%) sufre al menos una infección por VRS en los 2 primeros años de vida, y la mitad de ellos dos infecciones, siendo la principal causa de hospitalización en menores de un año. Existen factores de vulnerabilidad que aumentan el riesgo de hospitalización, como haber nacido prematuro o padecer enfermedades crónicas.
Sin embargo, se considera también que lo cierto es que cualquier lactante puede ser hospitalizado por VRS. En España, casi el 95% de los lactantes menores de 12 meses hospitalizados por VRS son niños que estaban sanos y, del mismo modo, 3 de cada 4 ingresos en la UCI pediátrica son niños sin factores de riesgo.
La carga clínica y económica de la infección grave por VRS, unida a las importantes consecuencias sobre los niños hacen de este virus uno de los principales impulsores de la demanda asistencial pediátrica (hospitalización y asistencia médica) y constituye un problema de salud pública en España. La media de visitas por VRS en menores de un año es de hasta 9 consultas en Primaria y 2 en urgencias,
El estudio Hospitalized RSV Monoclonal Antibody Prevention (HARMONIE) es un amplio ensayo clínico de intervención europeo, cuyo objetivo es determinar la eficacia y la seguridad de una dosis única intramuscular (IM) de nirsevimab en comparación con ninguna intervención (tratamiento estándar).
Esta medicación tiene por objetivo la prevención de hospitalizaciones por ETRI relacionadas con el VRS en lactantes menores de 12 meses que no son aptos para recibir palivizumab. Sanofi y los investigadores académicos colaboraron en el diseño y la ejecución de HARMONIE con soluciones digitales para minimizar la carga de las familias, el personal de los centros y los sistemas sanitarios.
El ensayo se abrió en casi 250 centros, con el apoyo de la infraestructura del National Institute of Health Research (Reino Unido), la red PEDSTART (Francia) y NETSTAP e.V. (Alemania), y ha reclutado a más de 8000 lactantes.21 Los datos principales de eficacia de HARMONIE se recopilaron durante la temporada de VRS 2022-2023.1 El seguimiento de los participantes concluirá a los 12 meses.
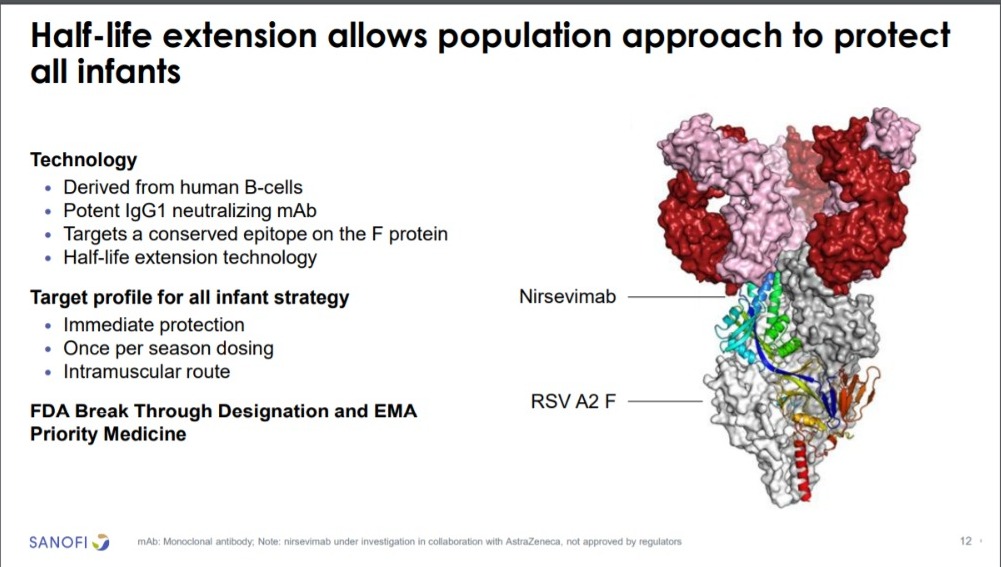
Sanofi y AstraZeneca están desarrollando conjuntamente nirsevimab, un anticuerpo de acción prolongada diseñado para proteger con una sola dosis a todos los lactantes frente a la enfermedad por VRS, desde el nacimiento y durante su primera temporada de VRS. Nirsevimab se ha desarrollado para ofrecer a recién nacidos y lactantes protección directa frente al VRS.
Esta protección se está desarrollando mediante un anticuerpo que ayuda a prevenir las infecciones de las vías respiratorias inferiores causadas por este virus y que requieren asistencia médica. Los anticuerpos monoclonales no requieren la activación del sistema inmunitario para ayudar a ofrecer una protección oportuna, rápida y directa frente la enfermedad.
A nirsevimab se le han concedido designaciones especiales para facilitar el desarrollo acelerado por parte de varias agencias reguladoras de todo el mundo, como de terapia Innovadora por parte de la agencia competente de China y la designación de terapia innovadora de la Administración de Alimentos y Medicamentos de los EE.UU (FDA).
También s ele ha dado el acceso al esquema de PRIORity MEdicines (PRIME) de la Agencia Europea de Medicamentos; la designación de Medicina Prometedora Innovadora por la Agencia Reguladora de Medicamentos y Productos Sanitarios del Reino Unido y ha sido nombrado “medicamento para el desarrollo prioritario” por la Agencia Japonesa para la Lnvestigación y el Desarrollo Médicos.
La EMA evaluó la seguridad y la eficacia de nirsevimab mediante un procedimiento de evaluación acelerada. Nirsevimab ha recibido la autorización de comercialización en la Unión Europea, el Reino Unido y Canadá para la prevención de la enfermedad de las vías respiratorias inferiores causada por el VRS en recién nacidos y lactantes desde el nacimiento hasta su primera temporada del VRS.
Actualmente se está sometiendo a revisión reglamentaria en los EE. UU. En Canadá, Beyfortus (nirsevimab) también está aprobado para niños de hasta 24 meses de edad que siguen siendo vulnerables a la enfermedad grave por el VRS hasta su segunda temporada del VRS. Nirsevimab aún no ha sido comercializado en España.
En marzo de 2017, Sanofi y AstraZeneca anunciaron un acuerdo para desarrollar y comercializar nirsevimab. Según los términos del acuerdo, AstraZeneca lidera las actividades de desarrollo y fabricación, y Sanofi lidera las actividades de comercialización y registra los ingresos. Sanofi realizó un pago por adelantado de 120 millones de euros.
También ha pagado hitos de desarrollo y regulación de 55 millones de euros y pagará hasta 440 millones de euros adicionales tras alcanzar ciertos hitos normativos y relacionados con las ventas. Las dos empresas comparten costes y beneficios en todos los territorios excepto en EE. UU., donde Sanofi consolida el 100 % de los beneficios económicos en sus ingresos operativos de negocio.